
La Química es parte de la Ciencia que estudia la obtención, las propiedades y la transformación de las Sustancias Puras y los sistemas que ellas forman.
La Ciencia es el conocimiento obtenido a través del llamado método científico.
El Método científico es un modo natural, ordenado, racional y sistemático de obtener el conocimiento. Este modo comienza con la observación de un fenómeno, continúa con la formulación de hipótesis que intentan explicar lo observado, prosigue con los experimentos que permiten confirmar y descartar las hipótesis. Como resultado de las actividades descritas se obtienen conocimientos particulares que se expresan mediante las leyes científicas. Una visión más general de un tema sostenida por varias leyes se denomina teoría.
Las Sustancias Puras son una manifestación más o menos sofisticada de la materia y la comprensión del concepto se alcanza luego de un estudio breve de los diferentes sistemas materiales.
La materia es todo lo que tiene masa o pesa y puede ser perceptible o imperceptible por nuestros sentidos.
Los Sistemas Materiales
El Estudio de los Sistemas materiales debe relacionarse fundamentalmente con aspectos estructurales y propiedades de la materia.

El Aspecto estructural fundamental es el carácter discontinuo, corpuscular o particulado de la materia que se manifiesta en fenómenos de difusión y cambios de estado físico.
Modelo Estructural Molecular de las Sustancias Puras
1 .- Un cierto tipo de partículas, llamadas moléculas, invisibles y que poseen cualidades que veremos a continuación, nos permiten comprender el concepto de Sustancia Pura.
2.- Una Sustancia Pura es un conjunto de moléculas idénticas, de igual tamaño, masa, y forma.
- Ejemplos:
Podemos así también inferir una definición de molécula: La menor porción material en que se puede presentar una Sustancia Pura.
3.- Las moléculas tienen la cualidad del movimiento, poseen Energía Cinética que es proporcional a la temperatura y además se atraen entre sí mediante fuerzas de atracción intermoleculares que son de naturaleza eléctrica.
4.- En los cambios de tipo físico, que para las sustancias puras ocurren a temperaturas bien definidas, las moléculas permanecen inalteradas y por ello a este tipo de cambios se les denomina comunmente reversibles.
Más información
- A los estados fisicos de la materia ya mencionados podemos agregar los estados de cristal líquido y el estado de plasma.
- ( Se denomina Plasma a un gas constituido por partículas cargadas de iones libres y cuya dinámica presenta efectos colectivos dominados por las interacciones electromagnéticas de largo alcance entre las mismas. Con frecuencia se habla del plasma como un estado de agregación de la materia con características propias, diferenciándolo de este modo del estado gaseoso, en el que no existen efectos colectivos importantes).
- Los cristales liquidos pueden presentar varios ordenamientos moleculares de tipo esméctico, estado nemático y colestérico.
( El Cristal líquido es un tipo especial de estado de agregación de la materia que tiene propiedades de las fases líquida y la sólida. Dependiendo del tipo de cristal líquido, es posible, por ejemplo, que las moléculas tengan libertad de movimiento en un plano, pero no entre planos, o que tengan libertad de rotación, pero no de traslación).
Segunda Clase de Química General_Martes 15 de Marzo del 2011
Las Sustancias Puras y las propiedades
Los cambios de tipo físico de una sustancia pura nos muestran la necesidad de considerar el aspecto propiedades de los sistemas materiales. Esto es, si bién se trata del mismo tipo de moléculas , las propiedades (color, densidad, viscosidad, temperatura, etc. ) del sólido difieren de las del líquido y éste de las del gas.
El aspecto propiedades de los sistemas materiales se enfrenta con el concepto de Fase.
Una Fase es una porción de materia que posee idénticas propiedades, tanto físicas como químicas, en toda su extensión. En consecuencia los cambios de estado físico son cambios de Fase. Entonces una Sustancia Pura puede ser una fase sólida o una fase líquida o una fase gaseosa dependiendo de la temperatura a la que se encuentre. Durante el cambio de estado coexisten dos fases a la temperatura de la transición correspondiente.

A una determinada presión y a una determinada temperatura, una Sustancia Pura puede presentar coexistencia (existencia simultánea) de tres fases como representa el gráfico a continuación.
La primera categorización de los Sistemas Materiales está basada exclusivamente en el concepto de Fase.
EJEMPLOS DE SISTEMAS HETEROGENEOS:
- 3 Fases
1 Sustancia Pura 2 Sustancias Puras
- 2 Fases
1 Sustancia Pura 2 Sustancias Puras
2 Sustancias Puras
Muchos sistemas heterogéneos, a simple vista aparentan ser homogéneos y su categoría se decide luego de un examen al microscópio. La leche constituye un buen ejemplo, a simple vista parece homogénea pero al microscópio se observa claramente como heterogénea. Los aceros constituyen otros ejemplos, son sistemas heterogéneos del tipo Fase Sólida.
1 Fase Sólida 2 o más complejos.
Estos sistemas que aparentan ser homogéneos pero al microscopio se observan heterogéneos reciben el nombre de coloides y la siguiente tabla muestra algunos tipos de ellos.
| Fase Dispersa | ||||
|---|---|---|---|---|
| Fase Continua | Gas | No es posible porque todos los gases son solubles entre sí | Aerosol líquido, Ejemplos: niebla, bruma | Aerosol sólido, Ejemplos: Humo, polvo en suspensión |
| Líquido | Espuma, Ejemplos: Espuma de afeitado | Emulsión, (Líquidos insolubles) Ejemplos: Salsa mayonesa, crema de manos, | Dispersión coloidal Suspensión o Sol, Ejemplos: Leche, Sangre, Pinturas, tinta china | |
| Sólido | Espuma Sólida, Ejemplos: piedra Pómez | Gel, Ejemplos: Gelatina, gominola, queso | Emulsión sólida, Ejemplos: Cristal de rubí | |
Clase de Química General_Viernes 18 de Marzo del 2011
ANALISIS DE SISTEMAS HETEROGENEOS : Analizar un sistema heterogéneo significa separar las diferentes fases que lo conforman.
TECNICAS DE SEPARACIÓN DE FASES DE SISTEMAS HETEROGENEOS:
- FILTRACIÓN
- FILTRACIÓN SIMPLE
- FILTRACION CON SUCCIÓN O DE VACÍO
- DECANTACION
- CENTRIFUGACIÓN
- SUBLIMACIÓN
- DISOLUCIÓN
- TAMIZACIÓN: No es una técnica de carácter sistemático, y tendría utilidad cuando el tamaño de grano del material particulado fuese significativamente diferente para cada una de las fases ( separación de arena de rio y harina ).
EJEMPLOS DE SISTEMAS HOMOGENEOS
- 1 Fase
Si observamos las fases líquidas del anterior ejemplo de sistemas homogéneos observamos una diferencia en cuanto al tipo de partículas que forman tales sistemas. De aquí aparece la necesidad de establecer otras categorías de sistemas materiales, esta vez respecto al número de tipos de partículas que forman el sistema.
EJEMPLOS DE SOLUCIONES
Las soluciones sólidas las encontramos en sistemas más conocidos como aleaciones ( bronce, aleación de cobre y estaño). La salmuera ( agua con sal común) es líquida y el aire (Oxígeno, Nitrógeno etc..) es gaseosa.
Los cambios de Estado Físico de las Soluciones también ocurren por variación de la temperatura. Los valores de las temperaturas de transición no son fijos como en las Sustancias Puras, sino que dependen de la proporción en que se encuentren los distintos tipos de moléculas.
Se consideran sistemas homogéneos porque los microscopios corrientes no tienen poder de resolución a nivel molecular
ANALISIS DE SISTEMAS HOMOGENEOS: Analizar un sistema homogéneo significa separar las diferentes Sustancias Puras o tipo de moléculas que lo conforman.
TECNICAS DE SEPARACIÓN DE SUSTANCIAS PURAS DESDE SISTEMAS HOMOGENEOS
El Rotavapor permite la destilación a presión reducida o ligero vacío, de esta forma se logra una disminución de la temperatura de ebullición del solvente. Esta modalidad es conveniente cuando se desea evitar que los solutos de origen biológico se "desnaturalicen " o deterioren por excesivo calentamiento.
EXTRACCIÓN POR SOLVENTE
El soluto es extraído del solvente original por un solvente extractor, inmiscuible con el primero, y que disuelve al soluto.
CRISTALIZACIÓN

La Solubilidad es la mayor cantidad de soluto, que en forma estable, se puede disolver en una determinada cantidad de solvente a una temperatura y presión dadas. Cuando la solución tiene disuelto la cantidad de soluto que corresponde a la solubilidad se dice que la solución está saturada
La Solubilidad de los sólidos en líquidos por lo general aumenta cuando aumenta la Temperatura.
CROMATOGRAFÍA: Las diferentes Sustancias Puras de una mezcla se pueden separar por Cromatografía. Una muestra ( mezcla de moléculas coloreadas azul y rojo en el siguiente gráfico) se siembra en un soporte fijo o estacionario. El flujo de una fase movil arrastra de diferente manera ( separa ) los distintos tipos de moléculas.
LAS SUSTANCIAS PURAS
Sabemos que una Sustancia Pura es un sistema formado por un tipo de moléculas características para esa Sustancia, es decir de tamaño, masa y forma bien definidas. Cuándo las Sustancias Puras reciben energía mayor que la necesaria para que acontezcan los cambios físicos sus moléculas se modifican, variando el tamaño, la masa y la forma, es decir se transforman en moléculas o Sustancia Puras distintas de las iniciales. En estos casos ha ocurrido un Cambio Químico o Reacción Química.
Cambio Químico
Sustancia (s) Pura (s) Inicial (es) ------> Sustancia (s) Pura (s) Final (es)
Molécula (s) Inicial (es) ------> Molécula (s) Final (es)
Reaccionante (s) ------> Producto (s)
Ley de la Conservación de la Materia (Lavoisier)
En un cambio químico la masa de los reaccionantes es igual a la masa de los productos
Ley de las Proporciones Definidas ( Proust)
La proporción en que los elementos se combinan para formar compuestos es definida o constante no importando la procedencia del compuesto.
EJEMPLO

El sulfuro de plomo es un compuesto (negro) formado por los elementos plomo ( plomo) en 86,4% y azufre ( amarillo) en 13,6 %. Esto significa que por cada 100 g. de sulfuro de plomo 86,4 g. corresponden a plomo y 13,6 g. a azufre.
Así, si colocamos en un crisol para hacer reaccionar y calentamos:0,864 g de plomo y 0,136 g de azufre se formará 1 g. de sulfuro de plomo.
Y, si colocamos en un crisol para hacer reaccionar y calentamos:
1,0 g de plomo y 0,136 g de azufre se formará 1 g. de sulfuro de plomo y sobrarán 0,136 g de Plomo
que no logran combinarse.
Clase de Química General_Martes 22 de Marzo del 2011
Ley de las proporciones Múltiples (Dalton)
Los pesos de un elemento que se combinan con una cantidad fija de un segundo elemento cuando se forman dos o más compuestos están en relación de números enteros.
MODELO ATÓMICO
Las leyes fundamentales recién estudiadas demuestran que las moléculas a su vez están formadas por otras partículas aún más pequeñas. Estas nuevas partículas se denominan átomos y deben poseer las siguientes cualidades:
1.- Los átomos son partículas, que mediante fuerzas denominadas enlace químico, se unen para formar las moléculas.
2.- Cada elemento tiene un átomo característico, es decir , de tamaño y masa determinados. Existen tantos tipos de átomos como de elementos. ( Los Elementos son aquellas Sustancias que mediante Símbolos se presentan en el Sistema Periódico)
3.- Si los átomos se presentan solitarios, o bien unidos del mismo tipo, se trata de moléculas de un Elemento.
Si los átomos se presentan unidos, de distinto tipo, se trata de molécula de un Compuesto.
4.- Un Cambio Químico es un reordenamiento de átomos
LOS ELEMENTOS Y LOS COMPUESTOS

Con esta visión más profunda de los aspectos estructurales de la materia (modelo atómico) se comprenden categorias aún mas finas de los sistemas materiales, esta vez en relación a las SustanciasPuras.
Análisis de Sustancias Puras
El análisis de Sustancias Puras corresponde al denominado Análisis Químico.
Análisis Químico Cualitativo Este comprende la separación e identificación de los elementos que forman un compuesto.
Análisis Químico Cuantitativo Este comprende la medición de la cantidad de cada uno de los elementos que forman el compuesto.
NOMENCLATURA QUIMICA Y EJEMPLOS
Un átomo de un Elemento se representa por su Símbolo

Un átomo de cobre se representa por su Cu

Un átomo de oxígeno se representa por O
Un átomo de hidrógeno se representa por H
Una molécula de una Sustancia Pura se representa por su Fórmula
Una molécula de Oxido de Cobre (I) se representa por Cu2O
El número de átomos del elemento se indica con un subíndice después del Símbolo y se llama Atomicidad.
Un reordenamiento de atomos de un cambio Químico se representa por su Ecuación
Cu2O + H2O = 2 Cu OH
El número de partículas idénticas se indica delante de la fórmula con el Coeficiente Estequiométrico
Ley de Volumenes de Combinación de Gases ( Gay Lussac)
Los volumenes de gases de Reaccionantes y Productos, medidos en iguales condiciones de Presión y Temperatura, están en relación de números enteros.
HIPOTESIS O PRINCIPIO DE AMADEUS AVOGADRO
- En volumenes iguales, de cualquier gas, medidos en iguales.
condiciones de P y T existe igual número de moléculas.
La Presión que ejercen las moléculas al chocar con las paredes del recipiente depende:
1) de la magnitud de los Impactos = masa x velocidad
(relacionable con la Energía Cinética = 1/2 masa x velocidad 2 y proporcional a la temperatura)
2) del número de Impactos ( proporcional al número de moléculas)
Avogadro razona:
Si las temperaturas son iguales, las magnitudes de los impactos son iguales (m v = m’v’, la molécula liviana se mueve rápido y la pesada se mueve lento) y si las presiones son iguales, el número de Impactos ( número de moléculas) son iguales
- La Hipótesis de Avogadro no sólo explica los experimentos de Gay Lussac y permite conocer la fórmula de las moléculas de gases simples, sino que permite, pesando volumenes iguales de diferentes gases medidos en iguales condiciones de P y T donde hay igual número de átomos, establecer la primera relación de masas de los diferentes átomos.
- Estos pesos permitieron las relaciones de la Ley de las Proporciones Recíprocas, que junto a otras reglas, permitieron conocer la masa relativa de otros átomos como los de elementos metálicos.
- Avogadro, cuando presentó su hipótesis en 1811, era un joven desconocido y su aporte no fue reconocido sino hasta el 1858 cuando la fuerza de lo verdadero se impuso. Medio siglo de masiva dependencia intelectual y carencia de espíritu crítico, situación incomprensible e inaceptable entre quienes se supone hacen la Ciencia.
UNIDAD 2
Clase de Química General_Viernes 25 de Marzo del 2011
LA MATERIA Y LA ELECTRICIDAD.
 Diferentes experimentos demuestran la existencia de dos tipos de electricidad, se les denomina la positiva y la negativa. Si dos cuerpos poseen igual tipo de carga se repelen en tanto que si tienen cargas de distinto signo se atraen. En sus experimentos de electrólisis, Faraday determinó la proporcionalidad entre la cantidad de sustancias transformadas y la cantidad de electricidad empleada. Surge la noción que la corriente eléctrica es un flujo de partículas que se les llamó electrones
Diferentes experimentos demuestran la existencia de dos tipos de electricidad, se les denomina la positiva y la negativa. Si dos cuerpos poseen igual tipo de carga se repelen en tanto que si tienen cargas de distinto signo se atraen. En sus experimentos de electrólisis, Faraday determinó la proporcionalidad entre la cantidad de sustancias transformadas y la cantidad de electricidad empleada. Surge la noción que la corriente eléctrica es un flujo de partículas que se les llamó electrones - Thompson demuestra experimentalmente, con el tubo de rayos catódicos la existencia de los electrones.
- Los electrones resultan ser partículas de carga eléctrica negativa cuya razón:
Carga

NOMENCLATURA PARA SISTEMAS ATOMICOS Y SUS MODIFICACIONES.



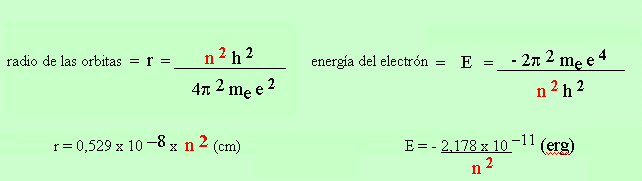




 Ante la imposibilidad de resolver la ecuación de Schorodinger para sistemas de varios electrones, se ha supuesto y con éxito, que sucesivos electrones adoptarán los diversos modos de vibración que se encontraron para el electrón de átomo de Hidrógeno.
Ante la imposibilidad de resolver la ecuación de Schorodinger para sistemas de varios electrones, se ha supuesto y con éxito, que sucesivos electrones adoptarán los diversos modos de vibración que se encontraron para el electrón de átomo de Hidrógeno.
En el caso de varios orbitales de igual energía o "degenerados" ( igual n + l , igual n ), por ejemplo una serie de 3 orbitales p, o una serie de 5 orbitales d, o bién una de7 orbitales f. Los electrones entran de a uno en cada uno de ellos, haciéndolo primero, por convención, con spin negativo. Cuando todos los orbitales " degenerados" ya hayan recibido un electrón con spin negativo pueden formarse parejas de spines opuestos.

Parece conveniente indicar en este momento que el principio de Hund promueve la situación que existan orbitales con un sólo electrón o electrón desapareado. Esta circunstancia tiene una importante consecuencia en las propiedades magnéticas de los elementos. Aquellas sustancias que poseen orbitales con electrones desapareados ( spin - 1/2) tienen propiedades paramagnéticas, esto es, los campos magnéticos de spín se suman, refuerzan o atraen los campos magnéticos externos, las sustancia son imantables.
De no suceder así, es decir, si todos los orbitales tienen electrones apareados ( spin + 1/2 y - 1/2 ) es una circunstancia que determina el diamagnetismo, la sustancia repele campos magnéticos externos y las sustancias no son imantables.


La repetición de las configuraciones electrónicas y la consiguiente conformación de un sistema de períodos y grupos es el fenómeno de carácter periódico más relevante. Sin embargo, hay otras propiedades atómicas importantes afectadas de carácter periódico.
El RADIO ATOMICO (R.A.)
El RadioAtómico disminuye "suavemente" al Aumentar Z en un Período. Si bién los electrones están similar orbital, la carga positiva del nucleo se incrementa ejerciendo progresivamente mayor atracción sobre los electrones. Se muestra la situación observando los electrones periféricos (dibujados en amarillo) en orbitales 2p para elementos del 2° Período.
_________________ = 1,76 . 10 8 (Coulomb / gramo)
Masa
LAS PARTICULAS INTRATOMICAS FUNDAMENTALES
Rutherford, bombardea una lámina de oro, con rayos a ( partículas "pesadas", cargadas positivamente)
Rutherford concluye que la lámina de oro es prácticamente vacía, o mejor, el átomo de oro concentra toda su masa en un núcleo de carga positiva de volumen muy pequeño en relación al volumen atómico total.
Comprende la presencia en el núcleo del átomo, de los protones, partículas cargadas positivamente y de masa mayor que la del electrón y que ya habían sido detectadas con el tubo de Thompson. También se comprende la presencia en el nucleo de los neutrones, partículas de igual masa que el protón pero sin carga eléctrica.

El nucleo, por la presencia de los protones, tiene carga positiva y por esta razón atrae los electrones (cargas negativas) que giran a su alrededor en órbitas semejantes, en una primera aproximación a las órbitas planetarias del sistema solar.
NUMERO MÁSICO CARGA ELÉCTRICA O ESTADO DE OXIDACIÓN A CARGA
SÍMBOLO S
NÚMERO ATÓMICO ATOMICIDAD Z X
DEFINICIONES
- NÚMERO ATÓMICO = NÚMERO DE PROTONES = Z
- NÚMERO MÁSICO = NÚMERO DE PROTONES + NÚMERO DE NEUTRONES = A
- CARGA ELECTRICA = NÚMERO DE PROTONES - NÚMERO DE ELECTRONES
DETERMINACIÓN DE LOS PESOS ATOMICOS O PESOS RELATIVOS
La existencia de isótopos (átomos de distinta masa) en todos los elementos debe ser tomada en cuenta cuando se trata de determinar las relaciones de los pesos de los átomos. En la actualidad es posible conocer los distintos tipos de isótopos que presenta un elemento en su estado natural y además es posible saber en que proporción o cantidad se encuentran gracias a la tecnología del espectrógrafo de masas.
El espectrógrafo de masas es un aparato en que por descargas eléctricas los átomos de un elemento se transforman en iones positivos. Estos iones son conducidos a la forma de un haz lineal hasta una zona en que son desviados mediante dispositivos magnéticos o eléctricos de acuerdo a la masa del ión ( los iones más pesados se desvían menos ). Así los iones en diferentes haces según su masa son detectados y cuantificados.
El Peso Atómico relativo se calcula de la siguiente manera:
A r = A1 * X1 + A2 * X2 + .............
Donde los A i son los Números Másicos o bién la masa en Unidades de Masa Atómica ( u.m.a.) de los distintos Isótopos y los X = % abundancia / 100
- unidad de masa atómica, 1 (u.m.a.), equivale a 1/12 de la masa del átomo de 12C.
- unidad de masa atómica prácticamente coincide con la masa de un protón o de un neutrón.
1 (u.m.a.) = 1, 67 . 10 - 24 ( g ).
UNIDAD 3
Clase de Química General_Martes 29 de Marzo del 2011
LA ENVOLTURA DE LOS
ÁTOMOS
La determinación de la disposición de los electrones alrededor del nucleo atómico ha sido un inmenso logro de científicos de las Matemáticas, la Física y la Química. Los resultados de las investigaciones muestran aspectos sorprendentes de la naturaleza de la materia y la energía. Estos aspectos, en relación al atomo, permiten fundamentalmente la comprensión del comportamiento químico de las sustancias.

LAS ONDAS ELECTROMAGNETICAS Y LA ENERGÍA
Las ondas electromagnéticas son campos eléctricos (E) y magnéticos (H) variables, oscilantes y mutuamente perpendiculares que se desplazan por el espacio y se relacionan íntimamente con el concepto de energía
- Onda electromagnética
MAGNITUDES Y CUALIDADES DE LAS ONDAS
A = Amplitud de la onda (La mayor oscilación respecto de la posición de equilibrio)
c = velocidad de propagación de la onda ( cm/ seg)
l = longitud de onda ( lambda) desplazamiento del frente de onda en un ciclo (cm)
T = Período ( tiempo de un ciclo ) (seg)
n = frecuencia ( nu ) = 1/T seg –1 = ciclos/seg = Hertz
Ecuación fundamental l = c T
:. l = c / n :. n = c / l :. n = 1 / l (N° de ondas ) cm -1

Un fenómeno inherente a la naturaleza de las ondas es la interferencia. Es decir, si las ondas se encuentran en fase se suman sus amplitudes, en cambio si las ondas están desfasadas se anulan mutuamente y la amplitud de la onda resultante puede ser nula.
El fenómeno de la difracción de las ondas es una clara manifestación de la propiedad de interferencia de las ondas. Los ribetes de claridad y oscuridad que acompañan la sombra de los bordes de la hoja de afeitar son consecuencia del fenómeno de la difracción y prueban la naturaleza ondulatoria de la luz.
EL ESPECTRO CONTINUO DE ONDAS ELECTROMAGNÉTICAS

- Al incidirlas ondas electromagnéticas sobre un prisma es posible separar las componentes según sus distintas frecuencias.
según la FÍSICA CLÁSICA LA ENERGÍA ERA DE NATURALEZA CONTINUA
Y LA ENERGÍA DE UNA ONDA ELECTROMAGNÉTICA ERA PROPORCIONAL A LA AMPLITUD DE LA ONDA.
Algunos experimentos cruciales
a) El espectro discontinuo de emisión del Hidrógeno
n cm-1
Según Ridberg la frecuencia de las señales está dada por la relación:
_
n = R H ( 1 / n2 - 1 / m2 ) RH = 109.677 cm –1
n y m enteros
b) El efecto fotoeléctrico.
FÍSICA MODERNA
LA ENERGÍA ES DE CARACTER DISCONTÍNUO
SE PRESENTA A LA FORMA DE PEQUEÑOS
"PAQUETES DE ENERGÍA "
QUE SE DENOMINAN CUANTOS, CUANTAS O FOTONES
LA ENERGÍA DE UNA ONDA ELECTROMAGNÉTICA ES PROPORCIONAL A SU FRECUENCIA
ECUACIÓN DE MAX PLANCK
ENERGÍA DE UN FOTÓN = h n
h = Constante de Planck = 6,62 10 -27 erg. seg
EL ATOMO DE HIDROGENO DE BOHR
(Principios Básicos de Química H.Gray)
1) Orbitas circulares
2) Momento angular = m e v r = n h / 2 p n = 1,2,3...........a
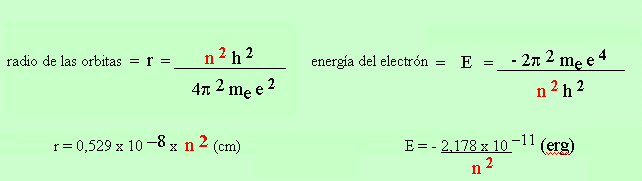
Energía asociada a los cambios de órbita

La formula anterior dá la frecuencia de los fotónes emitidos ( expresadas en Número de Ondas) para las transiciones de electrónicas de pérdida de energía en el átomo de Hidrógeno. Esta fórmula deducida a partir de consideraciones de discontinuidad de la energía ( Física Moderna) está en excelente acuerdo con la ecuación de Ridberg para el espectro discontinuo de emisión del átomo de Hidrógeno. Esta coincidencia en las expresiones fué un éxito para los postulados acerca de la energía de la Física Moderna y para el modelo atómico de Bohr. Sin embargo nuevos experimentos mostraron aspectos insatifactorios y la necesidad de otros modelos y explicaciones.

ECUACION ONDA PARTÍCULA DE SCHRODINGER
Ecuación diferencial de 2° orden para sistemas onda partícula, en tres dimensiones e independiente del tiempo donde:
h = constante de Planck,
y = Amplitud de la onda,
m = masa dela partícula
x,y,z = coordenadas de posición,
V(x,y,z ) = Energía Potencial,
E = Energía de la partícula
Resolver la ecuación es, lograr por integración, expresiones para:
y = f (x,y,z) ; E = g (x,y,z)
y 2 a Probabilidad de encontrar la partícula en x,y,z
El encontrar, mediante el cálculo, las zonas de alta probabilidad de encontrar la partícula equivale a determinar los orbitales.
ORBITAL
ZONA DE ALTA PROBABILIDAD DE ENCONTRAR UNA PARTÍCULA
La Ecuación de Schorodinger se aplica al átomo de Hidrógeno y se resuelve obteniendo expresiones para y y E del tipo trigonométricas. En estas expresiones aparecen los denominados números cuánticos n, l, y m cuyas combinaciones se asocian a zonas de alta probabilidad de encontrar el electrón u orbitales.
Clase de Química General_Viernes 01 de Abril del 2011
LOS NÚMEROS CUANTICOS, SU SIGNIFICADO,
SUS VALORES Y REGLAS DE COMBINACIÓN
n = Número cuántico principal.
Se asocia al tamaño y energia de los orbitales
¿Cuántos valores? infinito
¿Cuáles? 1,2 3,4,..............a ( Es el mismo n del átomo de Bohr)
l = Número cuántico secundario
Se asocia al tipo o forma de los orbitales
¿Cuántos valores? n
¿Cuáles? 0, 1, 2, 3, .........(n-1)
s p d f
Cada uno de los cuatro primeros valores se asocian respectivamente a las letras que se indican.
m = Numero cuántico magnético.
Se asocia con la orientación espacial de los orbitales
¿Cuántos valores? 2l +1
¿Cuáles? - l, - ( l-1 ), .... -1, 0, 1, ......+ ( l-1 ), + l
s = Numero cuántico de spín electrónico.
Se asocia al giro del electrón sobre su eje
¿Cuántos valores? 2
¿Cuáles? - 1 / 2 , + 1 / 2


GRÁFICOS DE ORBITALES
Los orbitales px , py y pz
Los 5 orbitales d
Los 7 orbitales f
ATOMOS POLIELECTRÓNICOS
 Ante la imposibilidad de resolver la ecuación de Schorodinger para sistemas de varios electrones, se ha supuesto y con éxito, que sucesivos electrones adoptarán los diversos modos de vibración que se encontraron para el electrón de átomo de Hidrógeno.
Ante la imposibilidad de resolver la ecuación de Schorodinger para sistemas de varios electrones, se ha supuesto y con éxito, que sucesivos electrones adoptarán los diversos modos de vibración que se encontraron para el electrón de átomo de Hidrógeno. En palabras más simples, los sucesivos electrones se ubicaran en los orbitales ya determinados para el átomo de Hidrógeno y de acuerdo a las siguientes reglas. Principio de exclusión de Pauli
No puede haber 2 electrones con los 4 números cuánticos iguales. Es equivalente a establecer que un orbital acepta un máximo de 2 electrones.
Principio de Estabilidad o menor Energía
Regla de Ta o de las diagonales.
Los electrones se ubican primero en los orbitales de menor energía.
Son de menor energía los de menor valor de n + l.
A igualdad de n + l se considera de menor energía los de menor n.
- Diagonales indican el orden de llenado ( energía creciente)
Clase de Química General_Martes 05 de Abril del 2011
Principio de Hund
En el caso de varios orbitales de igual energía o "degenerados" ( igual n + l , igual n ), por ejemplo una serie de 3 orbitales p, o una serie de 5 orbitales d, o bién una de7 orbitales f. Los electrones entran de a uno en cada uno de ellos, haciéndolo primero, por convención, con spin negativo. Cuando todos los orbitales " degenerados" ya hayan recibido un electrón con spin negativo pueden formarse parejas de spines opuestos.

PROPIEDADES MAGNETICAS DE LAS SUSTANCIAS
Parece conveniente indicar en este momento que el principio de Hund promueve la situación que existan orbitales con un sólo electrón o electrón desapareado. Esta circunstancia tiene una importante consecuencia en las propiedades magnéticas de los elementos. Aquellas sustancias que poseen orbitales con electrones desapareados ( spin - 1/2) tienen propiedades paramagnéticas, esto es, los campos magnéticos de spín se suman, refuerzan o atraen los campos magnéticos externos, las sustancia son imantables.
De no suceder así, es decir, si todos los orbitales tienen electrones apareados ( spin + 1/2 y - 1/2 ) es una circunstancia que determina el diamagnetismo, la sustancia repele campos magnéticos externos y las sustancias no son imantables.
GRÁFICO RESUMEN
Diagrama para llenado electrónico, orbitales disponibles y en orden de energía creciente
CONFIGURACIONES ELECTRÓNICAS Y ELECTRONES DE VALENCIA
- Los electrones de valencia son aquellos que se encuentran en los orbitales de mayor número cuántico principal más aquellos que están en orbitales con el número cuántico principal anterior al mayor a condición de estar incompletos.
SISTEMA PERIÓDICO DE LOS ELEMENTOS
Ubicación de los Números Atómicos por Configuraciones Electrónicas
UNIDAD 4
Clase de Química General_Viernes 08 de Abril del 2011
PROPIEDADES PERIODICAS DE LOS ELEMENTOS
- CUADRO PERIÓDICO


PROPIEDADES PERIODICAS DE LOS ELEMENTOS
La repetición de las configuraciones electrónicas y la consiguiente conformación de un sistema de períodos y grupos es el fenómeno de carácter periódico más relevante. Sin embargo, hay otras propiedades atómicas importantes afectadas de carácter periódico.
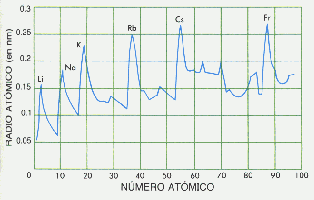
El RADIO ATOMICO (R.A.)
El siguiente gráfico muestra elocuentemente la variación periódica del Radio Atómico al avanzar el Número Atómico en los elementos. Se observa que los picks de mayor Radio Atómico corresponde a los metales alcalinos.
El RadioAtómico disminuye "suavemente" al Aumentar Z en un Período. Si bién los electrones están similar orbital, la carga positiva del nucleo se incrementa ejerciendo progresivamente mayor atracción sobre los electrones. Se muestra la situación observando los electrones periféricos (dibujados en amarillo) en orbitales 2p para elementos del 2° Período.




































Arregla el titulo Sale Portafolio de.. y nada mas xd falta tu nombre, lo demás ta piola xd
ResponderEliminarEste es la materia que se pasó en la primera clase de Química General, se los dejo para que tengan conocimiento de ello!
ResponderEliminar